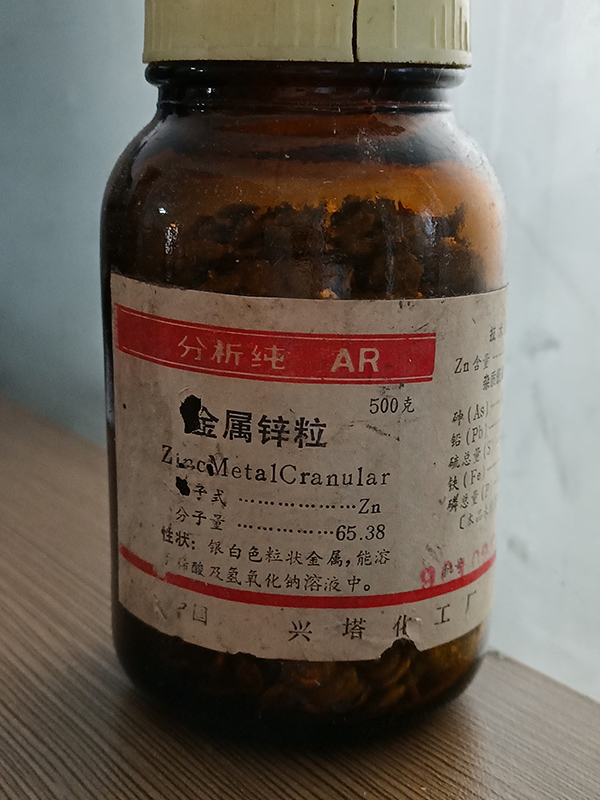
Цинк Металлический Гранулированный
Частицы цинка представляют собой химические вещества, а номер CSA — 7440-66-6.
Цинк — металл сине-белого цвета (плотноупакованная гексагональная кристаллическая система). Порошок представляет собой мелкий порошок светло-серого цвета. Температура плавления 419,58℃. Точка кипения 907℃. Относительная плотность 7.14. Давление пара 0, 13 кПа (487 ℃). Растворим в неорганической кислоте, щелочи, уксусной кислоте, нерастворим в воде.
Поскольку цинк легко образует защитную пленку на своей поверхности при комнатной температуре, наибольшее применение он находит в гальванической промышленности. Цинк может образовывать сплавы со многими цветными металлами, среди которых при литье под давлением широко используются сплавы на основе цинка, алюминия, меди и др. Латунь, состоящая из цинка, меди, олова и свинца, используется в машиностроении. Цинковые пластины, содержащие небольшое количество свинца, кадмия и других элементов, могут быть превращены в отрицательные электроды для сухих цинк-марганцевых батарей, печатные цинковые пластины, фотопластины с порошковой коррозией, пластины для офсетной печати и т. д. Цинк может вступать в реакцию с кислотами или сильными основаниями, вызывая выделять газообразный водород. Цинковые удобрения (сульфат цинка, хлорид цинка) могут стимулировать дыхание растительных клеток и углеводный обмен. В качестве пигментов можно использовать цинковый порошок, цинк-бариевые белила и цинк-хром-желтый. Оксид цинка также может использоваться в медицине, резиновой, лакокрасочной и других отраслях промышленности.
Реакция с соляной кислотой: на поверхности частиц цинка образуется большое количество пузырьков, выделяется большое количество тепла, и частицы цинка постепенно растворяются. Zn+2HCl=ZnCl2+H2↑
Реакция с серной кислотой: Zn+H2SO4=ZnSO4+H2↑ (Водород получен в лаборатории)
Реакция с гидроксидом натрия: Zn+2NaOH=Na2ZnO2+H2↑
Легко сделать взрывчатку